DESCRIPCIÓN HISTOLÓGICA DE LAS GLÁNDULAS SALIVARES MAYORES
DORIS ROSERO-SALAZAR, Enf.1, FREDDY MORENO-GÓMEZ, O.D.2
1Estudiante de Maestría en Ciencias Biomédicas. Profesora. Facultad
de Salud. Universidad del Valle. Cali, Colombia
2Magíster en Ciencias Biomédicas. Profesor. Facultad de Ciencias
de la Salud. Pontificia Universidad Javeriana. Cali, Colombia
RESUMEN
Las glándulas salivares mayores corresponden a tres
pares de órganos secretores exocrinos que morfofuncionalmente
se asocian al sistema digestivo como
estructuras glandulares anexas. En esta revisión de tema
se hace una descripción diferencial de los componentes
de las glándulas parótidas, submaxilares y sublinguales
teniendo en cuenta aspectos biológicos moleculares
dentro del contexto morfológico y funcional del sistema
digestivo. Dicha descripción se hizo de acuerdo al
abordaje histológico de los órganos glandulares a partir
del estroma (cápsula y tabiques como componentes
sustentaculares) y del parénquima (acinos y conductos
como componentes funcionales), para lo cual se
emplearon placas histológicas de muestras de glándulas
humanas teñidas con hematoxilina-eosina que hacen
parte de la colección de placas del Departamento de
Ciencias Básicas, Facultad de Ciencias de la Salud de la
Pontificia Universidad Javeriana Cali. Por tanto este
manuscrito corresponde a una guía histológica
fundamental de las glándulas salivales mayores y puede
constituirse en el punto de partida desde una condición
morfológica, fisiológica e histológica normal, hacia el
entendimiento de los procesos patológicos que alteran
precisamente, la forma y la función.
Palabras claves: Glándulas salivales mayores,
Glándula parótida, Glándula submaxilar, Glándula
sublingual, Saliva
SUMMARY
Major salivary glands correspond to three pairs of
exocrine secretory organs that morpho-functionally are
associated with the digestive system related glandular
structures. This literature review is a differential
description of the components of the parotid glands,
submandibular glands and sublingual glands,
considering molecular biological in the morphological
and functional context of the digestive system. Said
description will be made according to histological
approach of the glandular organs from stroma (capsule
and partitions as sustentacular components) and
parenchyma (acini and ducts as functional
components), which were used for histological slides of
samples of human glands stained with hematoxylineosin
that are part of the collection of the Department of
Basic Sciences, Faculty of Health Sciences at the
Pontificia Universidad Javeriana Cali. Therefore this
manuscript corresponds to a fundamental histological
guide of the major salivary glands and constitutes the
start point from a morphological, physiological and
histological normal condition to the understanding of
disease processes that alter precisely, shape and
function.
Key words: Major salivary glands, Parotid gland,
Submaxillary gland, Sublingual gland, Saliva
Recibido para publicación: octubre 15, 2013
Aceptado para publicación: abril 15, 2014
INTRODUCCIÓN
El sistema digestivo comprende una serie de órganos
con características morfo-funcionales específicas y que
en conjunto contribuyen con la absorción de los
alimentos. El abordaje histológico del sistema digestivo
desde el punto de vista académico se hace con base a la
nutrición, razón por la cual los tejidos fundamentales y
sus asociaciones sistémicas son descritos desde la
integración funcional de la cavidad oral (labios, bucas,
paladar duro, paladar blando, lengua y piso de boca), la
faringe (compartida con el sistema respiratorio), el tubo digestivo (esófago, estómago, intestino delgado -
duodeno, yeyuno e ileón-, intestino grueso -colon,
ciego, recto y apéndice), y órganos anexos (glándulas
salivales mayores, hígado, páncreas y vesícula biliar).
En los mamíferos, las glándulas salivales varían su
estructura histológica y la composición de la saliva
entre las distintas especies(1).
Corresponden a órganos accesorios de la cavidad oral
cuya función es secretar saliva como respuesta a un
estímulo psíquico o físico. De acuerdo a su ubicación se
pueden clasificar en extramurales o glándulas salivales
mayores o principales (parótidas, submaxilares o
submandibulares y sublinguales); e intramurales o
glándulas salivales menores localizadas en la mucosa
(lámina propia) y en la submucosa (entre las fibras de
músculo esquelético) de diferentes regiones de las
paredes de la cavidad oral (labios, bucas, paladar duro y blando, lengua y orofaringe). Todas estas glándulas
secretan una solución acuosa hipotónica diluida que
contiene sustancias orgánicas e inorgánicas denominada
saliva, la cual varía su composición a razón de las
características de las células secretoras que constituyen
las glándulas salivales(2).
Histológicamente, consisten en múltiples unidades
secretoras conectadas a la cavidad oral a través de un
sistema de conductos. Las unidades secretoras
básicamente son un conglomerado de células serosas
(secreción de componentes proteicos) y mucosas
(secreción de componentes glucosídicos) organizadas
morfo-funcionalmente en estructuras redondeadas o
acinares, o en estructuras elongadas o tubulares que se
encargan de producir saliva(3). De interés de esta revisión,
las glándulas salivares mayores (GSM) constituyen
órganos pares propiamente dichos que hacen parte
morfo-funcional del sistema estomatognático y cuya
función es secretar y excretar saliva (97% de la saliva
total) hacia la cavidad oral con los objetivos de: 1.
Mantener húmeda y lubricar la mucosa oral, faríngea y
esofágica; 2. Mantener el equilibrio ecológico de la
microflora oral; 3. Facilitar el funcionamiento del
sentido del gusto en la percepción de sabores; 4.
Contribuir con la disolución, suspensión, conformación
y deglución del bolo alimenticio; 5. Iniciar el proceso de
digestión; 6. Mantener la integridad de la mucosa oral; 7.
Comportarse como una solución biológica
amortiguadora; 8. Remineralización de los dientes; y 9.
Constituir la primera barrera de defensa de la cavidad
oral(4-9).
De esta forma, el objetivo de esta revisión de tema es
hacer una descripción histológica de las tres glándulas
salivales mayores a partir de placas con muestras
humanas teñidas con hematoxilina-eosina, asociando las
diversas estructuras histo-morfológicas a la fisiología,
teniendo en cuenta que en la literatura, los estudios
experimentales sobre la función de las glándulas
salivales son principalmente en modelos animales (ratas
y conejos) y unos pocos, mediante procedimientos no
invasivos, en humanos.
MORFOGÉNESIS DE LAS GLÁNDULAS
SALIVARES MAYORES
Como todas las glándulas exocrinas del organismo, las
GSM se originan morfológicamente de forma similar
mediante la invaginación y proliferación de células
epiteliales en el tejido conectivo subyacente y el posterior aislamiento de este último tras la secreción y montaje de la membrana basal durante la sexta y
séptima semana del desarrollo. Por tanto, las células
epiteliales que constituyen los acinos y los conductos
conformarán el epitelio glandular del parénquima,
mientras que el tejido conectivo del estroma le dará
soporte al primero(10).
Las GSM se forman durante la sexta y séptima semana
de vida intrauterina a partir de brotes epiteliales del
ectodermo que se introducen en el mesénquima
subyacente(mesodermo combinado con
neuroectodermo –células de la cresta neural–) próximo
al estomodeo en las prominencias maxilares y
mandibulares del primer arco faríngeo. De las células
del ectodermo se diferenciaran las células epiteliales
acinares y epiteliales cúbicas que conformarán los
acinos y el sistema de conductos del parénquima
respectivamente; mientras que del mesénquima se
originará el tejido conectivo del estroma a manera de
una cápsula que rodea todo el parénquima y de
numerosos tabiques que segmentan el parénquima
dándole soporte estructural(11-13).
Por tanto, este proceso de morfogénesis implica
interacciones mesénquimo-epiteliales que regulan
directamente el desarrollo de un mecanismo de
ramificación que induce la conformación del
parénquima de órganos como el pulmón, el riñón, las
glándulas mamarias y las glándulas salivares; a partir
de múltiples bifurcaciones que conllevan a la
formación de nuevos crecimientos epiteliales, los
cuales son regulados de forma heterotópica
(interacción de dos tejidos de diferente origen
embrionario) por el mesénquima, sin embargo, el tipo
de secreción a partir de la citodiferenciación de las
células que constituyen los acinos estará regulado por
el epitelio(14,15).
El desarrollo embrionario de las GSM puede
clasificarse morfológicamente en cuatro etapas o
períodos de acuerdo a la descripción histológica que se
inician con el primer signo de morfogénesis o
engrosamiento del epitelio oral: 1. Etapa de yema
inicial o pre-yema que corresponde al a invaginación
del epitelio en el mesénquima subyacente para
conformar una yema que se mantiene en contacto con la
superficie a través de una “cordón epitelial primario” la
cual posteriormente hará parte de la porción más
proximal del conducto excretor; 2. Etapa
pseudoglandular en la que la yema se bifurca, se ramifica y se diferencia en múltiples brotes o cordones
epiteliales que le proporcionan a la glándula el aspecto
multi-lobulado; 3. Etapa canalicular en la que las
porciones excretoras (cordones epiteliales secundarios
que darán origen a los conductos) y secretoras (yemas
distales que darán origen a los acinos) se canalizan por
apoptosis de células epiteliales para dar origen al lumen
por donde pasaran los productos secretados; y 4. Etapa
terminal o de citodiferenciación en la que se desarrollan
funcionalmente las células epiteliales acinares a partir
de las yemas distales. Es importante mencionar que
conforme se desarrolla el patrón de bifurcación y se da la
ramificación de las estructuras epiteliales, éstas se
comportan como una “plantilla” para que el sistema
circulatorio (arterias, venas y linfáticos) y el sistema
nervioso acompañen los conductos y acinos desde el
tejido conectivo denso irregular de la cápsula, el tejido conectivo denso irregular de los tabiques y el tejido
conectivo laxo que rodea dichas estructuras(15,16).
Es así como las glándulas parótidas se desarrollan al
inicio de la sexta semana a partir de yemas epiteliales
que surgen del ectodermo de la cavidad oral próximo a
los ángulos del estomodeo y crecen en dirección del
conducto auditivo externo en la medida que se
diferencian en cordones epiteliales ramificados. El brote
epitelial se mantiene proximalmente en contacto con el
estomodeo en lo que ha futuro se constituirá el lugar por
donde será excretada la saliva (carúnculas parotídeas) en
la cavidad oral. Posteriormente en la décima semana
estos cordones se diferencian a conductos y los extremos
distales se diferencian en los acinos, los cuales
empezarán a secretar saliva en la decimoctava semana.
Las glándulas submaxilares surgen al final de la sexta
semana de desarrollo a partir de yemas epiteliales
originadas del endodermo del intestino primitivo
anterior en el piso del estomodeo, para proliferar hacia el
mesénquima en sentido posterior a través de cordones
epiteliales que a la decimosegunda semana se
diferencian en conductos y en los extremos más distales
en acinos, los cuales a su vez inician su actividad
secretora en la decimosexta semana, sin embargo,
posterior al nacimiento, se continúa la diferenciación y
conformación de nuevos acinos mucosos. De igual
forma que ocurre en parótida, la yema epitelial mantiene
su conexión con la cavidad oral para el desarrollo del
conducto excretor en las carúnculas linguales. Las
glándulas sublinguales surgen en la octava semana de
desarrollo a partir de múltiples yemas epiteliales cuyo origen se encuentra en el endodermo del intestino
primitivo anterior. Cada una de las yemas se ramifican y se canalizan para constituir proximalmente varios
conductos independientes (de 10 a 12) que se abren
hacia el piso de la boca, mientras que distalmente se
diferencian los acinos(11-13,17,18).
ESTRUCTURAS HISTOLÓGICAS
Las glándulas salivales mayores (GSM) consisten en
tres tipos de glándulas pares que comparten ciertas
características morfo-funcionales, pero que
histológicamente presentan diferencias significativas
asociadas a la constitución del tipo de saliva que
secretan; por tanto, el abordaje funcional hará a partir
de su clasificación histo-morfológica como glándulas
túbulo-acinares compuestas, en donde la parte externa
sustentacular o estroma (cápsula y tabiques o
trabéculas encargadas de sostener, dividir y
circunscribir el parénquima en lóbulos y lobulillos) y
de la parte interna funcional o parénquima (sistema de
acinos y conductos que constituyen la parte funcional
de la glándula). El estroma de las GSM se encuentra
constituido por una cápsula de tejido conectivo denso
irregular que se invagina en el parénquima y lo divide
en lóbulos a partir de trabéculas interlobulares de tejido
conectivo denso irregular, las cuales sostienen vasos
(arterias y venas) de gran calibre, linfáticos, nervios y
conductos interlobulares. De estas trabéculas se
desprenden de igual forma trabéculas interlobulillares
más pequeñas de tejido conectivo denso irregular que
dividen los lóbulos en lobulillos y que sostienen vasos
(arterias y venas) de pequeño calibre, linfáticos,
nervios y conductos interlobulillares. Sin embargo, son
los componentes del parénquima, acinos (porción
secretora) y conductos (porción excretora –conductos
intercalados y conductos estriados principalmente–),
los que constituyen la unidad funcional básica de las glándulas salivales, sialona o salivón(10,19).
PORCIÓN SECRETORA
Las porciones secretoras de las glándulas salivales de
los mamíferos se encuentran constituidas por células
secretoras que se asocian para conformar los acinos,
alveolos o adenómeros. En las GSM existen dos tipos
de células secretoras que se encargan de producir la
saliva dentro de los acinos y que en últimas permiten
clasificar las glándulas de acuerdo al tipo de secreción;
de esta forma es posible identificar las células serosas
(secreción acuosa rica en enzimas) y las células
mucosas (secreción viscosa constituida por proteínas
glicosiladas). Un tercer grupo de células, las mioepiteliales, comparten y se asocian al acino a través
de la membrana basal de las células acinares y permiten,
por contracción, la salida de la saliva del acino y su
posterior conducción por el sistema de conductos(10).
Por fuera de la membrana basal, se observa un tejido
conectivo laxo (rico en linfocitos y células plasmáticas)
que cumple las funciones de sostén y que se continúa con
el tejido conectivo denso irregular de las trabéculas y la
cápsula, lo que permite la llegada de vasos, linfáticos y
nervios hasta el acino.
Como epitelio glandular, las GSM se constituyen en
glándulas exocrinas que vierten sus contenidos a través
de un sistema de conductos a la cavidad oral. Estas
glándulas están constituidas por células epiteliales
serosas y mucosas morfológicamente especializadas
capaces de secretar de forma merocrina (vía exocíticasecretora),
sin alterar la composición del citoplasma y
de la membrana celular, gran cantidad de componentes
proteicos y glucocídicos funcionalmente
especializados. Estos dos tipos de células altamente
permeables al agua se encargan de realizar la función
secretora en el acino, mientras que un tipo de célula
impermeable al agua se encarga de cumplir con la
función excretora a través del sistema de conductos; sin
embargo, las células epiteliales de los conductos tienen
la capacidad de reabsorber electrolitos como sodio y
cloro y secretar potasio y bicarbonato, razón por la cual
de los acinos sale una saliva primaria isotónica respecto
al plasma que en el sistema de conductos pasa a una
saliva secundaria hipotónica (que le confiere sus
propiedades de solución buffer o amortiguador
biológico), para finalmente ser excretada a la cavidad
oral(20-22). Esta secreción discontinua de fluidos (serosos y
mucosos) y electrolitos, requiere de la regulación de
agonistas que producen un aumento de calcio
intracelular(23), canales específicos de agua del tipo
acuaporinas (AQP5) presentes en las membranas
celulares del dominio apical de las células epiteliales de
los acinos y de los conductos intercalares, y activación de la vía paracelular regulada por las uniones estrechas
(proteínas ocludinasy claudinas)(21,22,24).
Debido a que las GSM se encuentran inervadas por
nervios simpáticos y parasimpáticos, la estimulación
simpática a través de norepinefrina regulará la secreción
de componentes proteicos, mientras que la estimulación
parasimpática a través de acetilcolina regulará la
secreción de componentes glucídicos y agua. Las células epiteliales acinares, organizadas morfo-funcionalmente en un acino, en el dominio basal
expresan receptores adrenérgicos (paranorepinefrina)
y muscarínicos (para acetilcolina). Esta primera señal,
a partir de neurotransmisores, estimula a las células
acinares para producción de la saliva primaria,
activando dentro del citoplasma una cascada de
segundos mensajeros como proteínas G para
transducción de señales, AMP cíclico para exocitósis
de proteínas y glicoproteínas, e inositol trifosfato para
movilización de calcio y posterior secreción de
fluidos(20,22).
CÉLULAS ACINARES SEROSAS
Su morfología es piramidal con la base hacia la
membrana basal y el ápice hacia la luz del acino seroso,
lo que permite que la porción secretora sea redondeada
o acinar (figuras 1, figura2, figura 3). En tinciones con hematoxilinaeosina
el citoplasma tiñe intensamente eosinófilo y el
núcleo grande, redondo y basal tiñe intensamente
basófilo. Todas las células serosas, cuyos límites
intercelulares son poco visibles, dirigen su vértice hacia
una pequeña luz en el centro del acino seroso que se
continua con el conducto intercalar. En microscopia
electrónica de transmisión se pueden identificar en el
citoplasma infranuclear las organelas del sistema
exocítico-secretor (abundantes mitocondrias basales,
retículo endoplasmático, ribosomas libres, aparato de
Golgi y múltiples gránulos secretores de cimógeno
supranucleares –propios de células que secretan
proteínas– en el dominio apical) bien desarrolladas, en
el dominio lateral prolongaciones citoplasmáticas
interdigitadas con células contiguas estabilizadas por
los diferentes tipos de unión celular que constituyen la
barra terminal (uniones ocluyentes, uniones adherentes
–desmosomas– y uniones comunicantes), y en el
dominio basal una membrana basal que permite
relacionar la célula con el tejido conectivo laxo
subyacente(10).
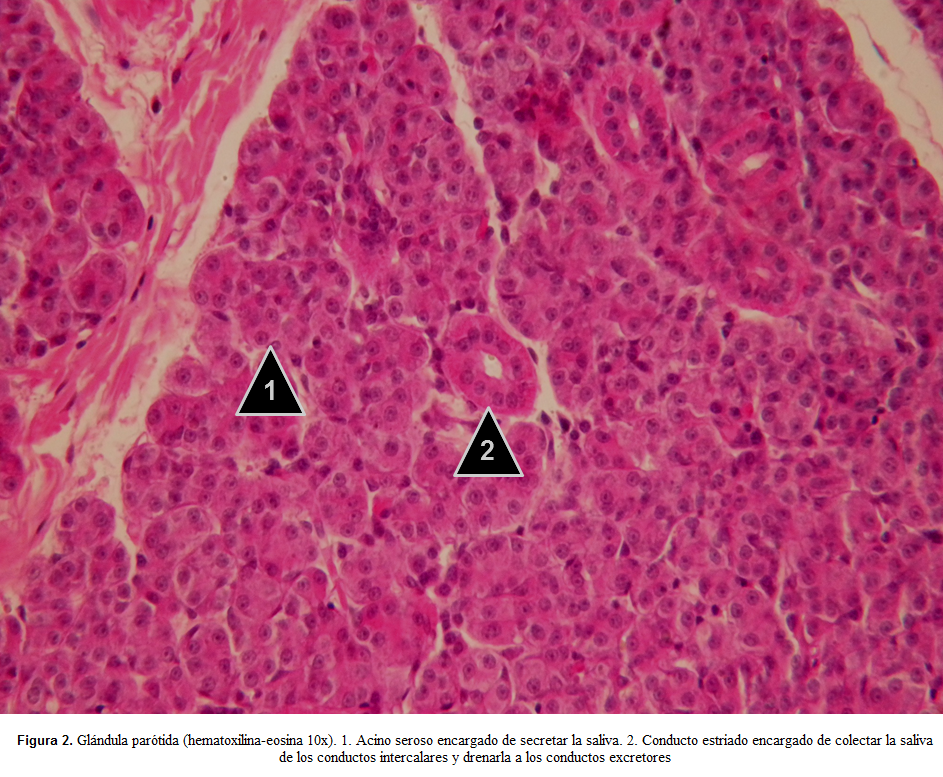
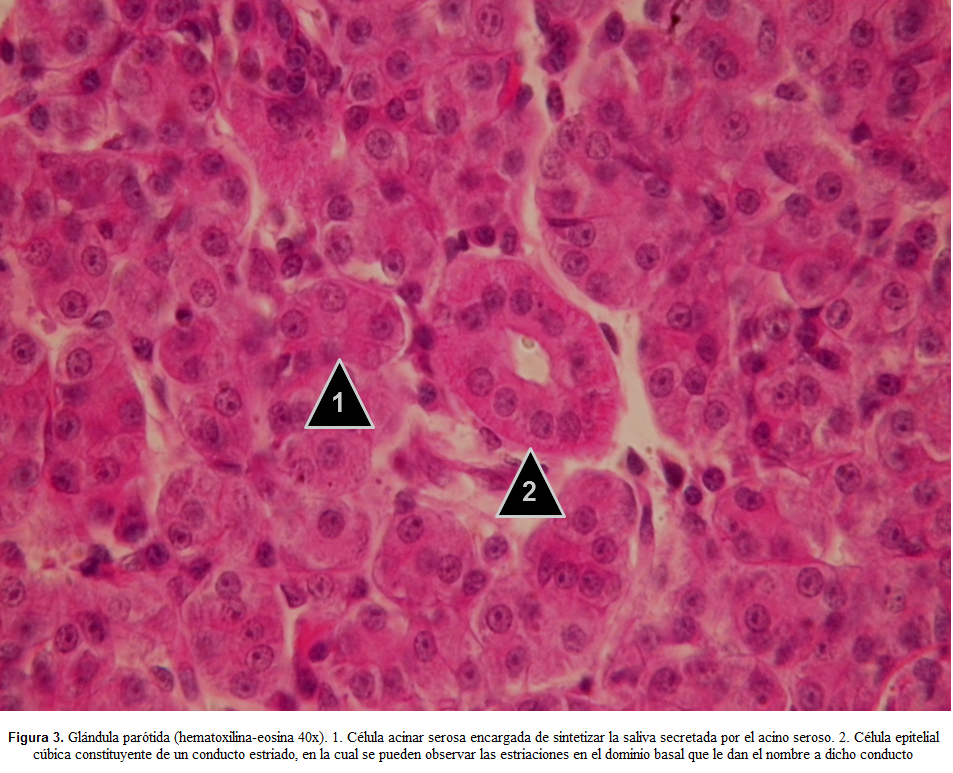
El producto de secreción es rico en amilasas,
peroxidasas, lactoperoxidasa, lisozimas, ribonucleasas, desoxirribonucleasas, lipasas, factor de
crecimiento nervioso, factor de crecimiento
epidérmico, inmuglobulinas (IgA) y glicoproteínas multifuncionales implicadas en la protección
mecánica, captura de microrganismos, propiedades
antimicrobianas y prevención de la deshidratación de
los epitelios oral(15,25).
En las tres GSM el mecanismo para secretar proteínas es la exocitosis, proceso que implica la fusión de la membrana de los gránulos secretores con la membrana plasmática del polo apical de la célula epitelial acinar serosa, seguido por la ruptura de las membranas fusionadas y posterior salida de los contenidos hacia la luz o lumen del acino. Este proceso es continuo en la mayoría de las células (exocitosis constitutiva), pero la velocidad de secreción puede ser regulada por el sistema nervioso autónomo, en donde el sistema simpático estimula los acinos serosos de las parótidas y las submaxilares, mientras que el sistema parasimpático estimula las sublinguales(21).
El ritmo de secreción es discontinuo, de tal forma que su aspecto histológico varía de acuerdo al estado funcional, en donde una célula en reposo tendrá abundantes gránulos cimógenos, acidófilos y acumulados en el dominio apical, mientras que una célula activa carecerá de gránulos debido a su exocitosis(25).
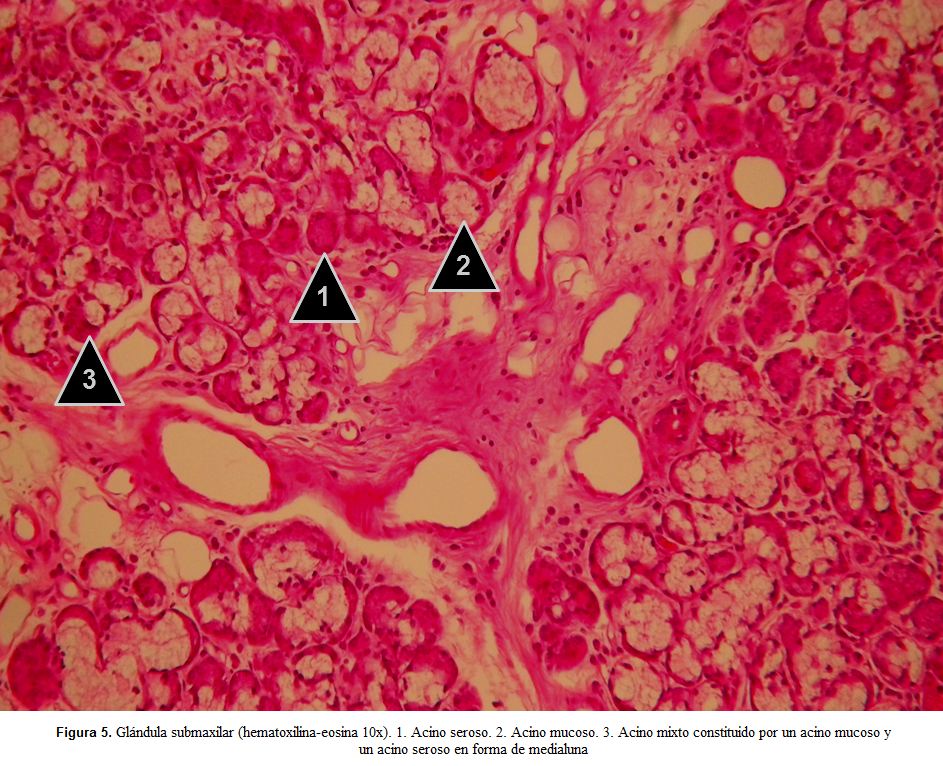
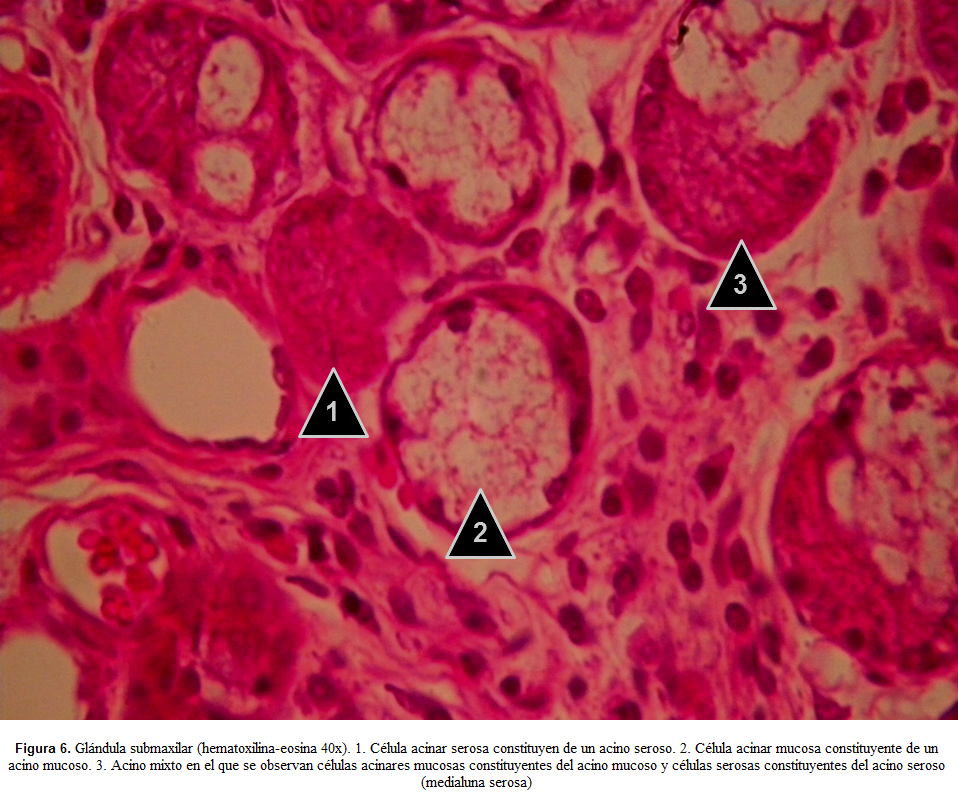
En los acinos mixtos (acinos que cuentan con células serosas y mucosas), las células serosas se ubican en medio de las células mucosas y su ápice no llega hasta la luz del acino, por lo que sus productos son vertidos a través de canalículos secretores que transcurren por el espacio intercelular conformado entre dos células mucosas vecinas3 (figuras 4, figura 5, figura 6). En los cortes histológicos, las células serosas se observan desplazadas hacia le periferia conformando un artefacto histológico conocido como la medialuna serosa o casquete seroso. Este fenómeno ocurre por la tumefacción de las células mucosas por acción de los fijadores convencionales como el formol buferado(19).

De igual forma han sido descritas un tercer grupo de células acinares, las seromucosas, las cuales secretan ciertos componentes glucídicos, sin embargo, la mayor cantidad de secreciones son de origen proteico(26).
Células acinares mucosas
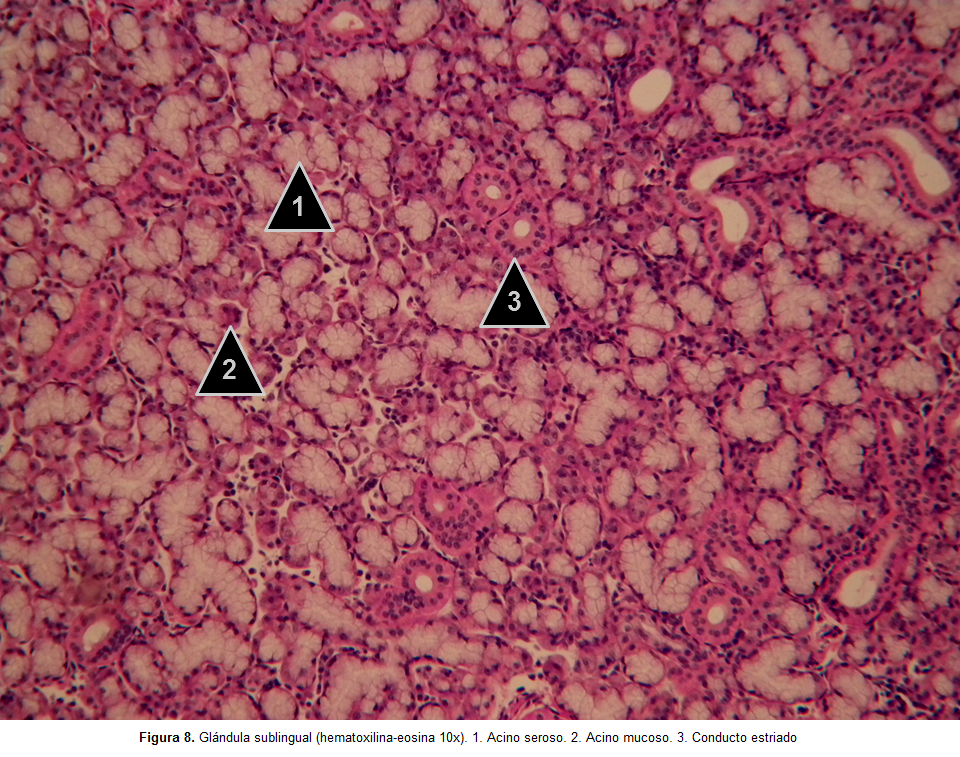
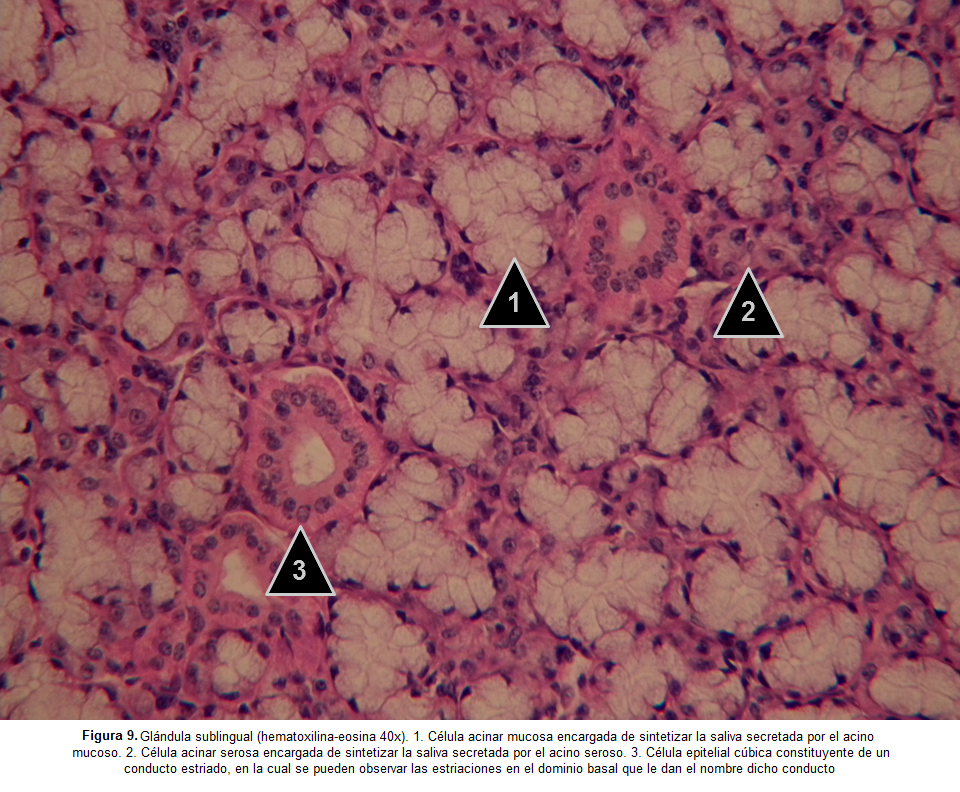
Su morfología es similar a las células acinares serosas. En tinciones de hematoxilina-eosina el citoplasma se observa con eosinofilia o basofilia pálida (dada la poca afinidad de los mucinógenos por los agentes colorantes de la técnica convencional de hematoxilina-eosina) y el núcleo basal se observa aplanado e intensamente basófilo (figuras 7, figura 8, figura 9). Las células piramidales, mucho más redondeadas, confluyen su ápice hacia el centro del acino cuya luz más amplia se continúa con el conducto intercalar(10,19).
En microscopía electrónica de transmisión, las células epiteliales acinares serosas se aprecian fuertemente unidas entre sí mediante el dominio lateral a través de interdigitaciones de la membrana plasmática y desmosomas entre dos células vecinas, del mismo modo que presentan microvellosidades apicales proyectadas hacia el lumen del acino y un citoplasma en el que se observa el sistema exocítico-secretor asociado a abundantes gránulos secretores de mucinógeno, un retículo endoplasmático menos desarrollado y un aparato de Golgi más extenso, lo cual es indicador de secreción de carbohidratos(27). Como otras células muco-secretantes, la actividad de secreción glucídica, que corresponde principalmente a mucinas, es cíclica, de tal forma que alguna parte de la secreción sintetizada se almacena en gránulos de mucinógeno para re-sintetizar los productos cuando el estímulo haya cesado(25).
El tipo de secreción de las células acinares mucosas son mucinas, las cuales son glicoproteínas con grandes cadenas de carbohidratos(15). Mucinas cargadas negativamente y secretadas por las GSM proporcionan las características visco-elásticas a la saliva para, al recubrir la mucosa de la cavidad oral, protegerla del daño mecánico y la colonización de patógenos exógenos(28,29). Las principales mucinas secretadas por las células mucosas son MG1 y MG2, las cuales tiene como función lubricar y proteger la mucosa oral constituyendo una barrera (película adquirida) que impide la desecación y que fija microorganismos facilitando su remoción(30).
Células mioepiteliales
Son células de origen epitelial con capacidad mitótica, funcionalmente muy similares a las células musculares lisas, con variaciones en su morfología (estrellado, triangular o trapezoidal) y núcleos normalmente aplanados en sentido longitudinal respecto al acino o al conducto. Se encuentran estrechamente relacionadas con los acinos y el segmento proximal de los conductos intercalares y constituyendo una estructura muy similar a una cesta (presentan numerosas prolongaciones citoplasmáticas que se interponen entre sí con las prolongaciones de otras células mioepiteliales con figurando un aspecto de tejido, razón por la cual han sido denominadas como “células en cesta”) fuertemente estabilizada por uniones celulares del tipo desmosoma y uniones comunicantes(27), de tal forma que comparten la membrana basal con las células epiteliales acinares y las células epiteliales cúbicas respectivamente(10,31).
Dada su capacidad de contractibilidad (mecanismo a partir de filamentos de actina y miosina citoplasmáticas), ayudan a expulsar la saliva desde el acino para transportarla hacia los conductos de intercalares mediante compresión(16), cuando la función secretora de la glándula es estimulada por las vía simpáticas y parasimpáticas mediante receptores beta adrenérgicos(32).
Porción excretora
El sistema de conductos de las GSM se encuentran constituidos de forma general por un células epiteliales cúbicas que podrán aumentar o disminuir su tamaño dependiendo el tramo de la red de conductos en el que se observe el corte histológico, de esta forma los conductos intercalares y estriados se encuentran constituidos por un epitelio cúbico simple mientras que los conductos excretores variarán desde un epitelio cúbico simple que se continua de los conductos estriados a un epitelio cilíndrico estratificado, para terminar con un epitelio plano estratificado mucoso en la región de las carúnculas al momento de desembocar en la cavidad oral. En microscopía electrónica de transmisión, estas células presentan un citoplasma con pocas organelas y escasos gránulos cimógenos(27).
Las células epiteliales que constituyen los conductos intralobulillares intercalares (ubicados en el parénquima), se originan directamente del acino y se continúan con un conducto de mayor calibre. En las glándulas parótidas, las células epiteliales que conforman los conductos intercalares tienen la capacidad de modificar la saliva primaria, por tanto en las glándulas parótidas y en las submaxilares (mixtas con predominio seroso) los conductos intercalares son mas desarrollados que en las glándulas sublinguales (mixtas con predominio mucoso), en donde, si están presentes, son más cortos y difíciles de identificar. La capacidad de modificar la saliva primaria y conformar la saliva secundaria obedece a la actividad de anhidrasa carbónica, dado que secretan iones bicarbonato y absorben iones cloruro(19,33). De igual forma, se ha demostrado que estas células epiteliales tienen una gran capacidad mitótica, de tal forma que se encargan de la regeneración de las porciones secretores y de las porciones excretoras(3).
Los conductos intralobulillares estriados (ubicados en el parénquima) se encuentran constituidos por un epitelio cilíndrico simple cuyas células observadas en microscopía electrónica de transmisión, cuentan con microvellosidades en el dominio apical, interdigitaciones de la membrana celular en el dominio lateral y desmosomas entre células vecinas y abundantes mitocondrias y repliegues de la membrana celular en el dominio basal(27) (Figuras 3 y 9). Estos repliegues de la membrana celular sumado a la gran cantidad de mitocondrias constituyen las estriaciones basales intensamente eosinófilas características en los cortes teñidos con hematoxilina-eosina y que algunos autores han denominado el “laberinto basal”(19,33).
En el dominio apical, las células epiteliales de los conductos estriados tienen la capacidad de reabsorber cloro y sodio a partir de la saliva primaria isotónica por medio de canales de sodio selectivos ubicados en la membrana plasmática del dominio apical (característicos de los tejidos epiteliales con funciones de absorción), los cuales son regulados por el aumento de la concentración de sodio extracelular y por la proteína G de forma intracelular, para obtener una saliva definitiva hipotónica. Parte del sodio reabsorbido será devuelto a la sangre por el dominio basal de la célula epitelial en cuya membrana celular se observa gran actividad de la bomba sodio-potasio. Dicha activad se encuentra aumentada por los repliegues basales de la membrana celular y la gran cantidad de mitocondrias(34-37).
Los conductos excretores se encuentran constituidos en su extremo más distal por un epitelio cilíndrico simple que se continua de los conductos estriados y que, conforme se va aproximando a la superficie epitelial de la mucosa de revestimiento de la cavidad oral cambia a un epitelio cúbico o cilíndrico pseudoestratificado que cuenta con la presencia de células caliciformes (secretoras de mucinas), para finalmente conformar un epitelio plano estratificado en su extremo más proximal(3,19)
DISCUSIÓN Y RESULTADOS
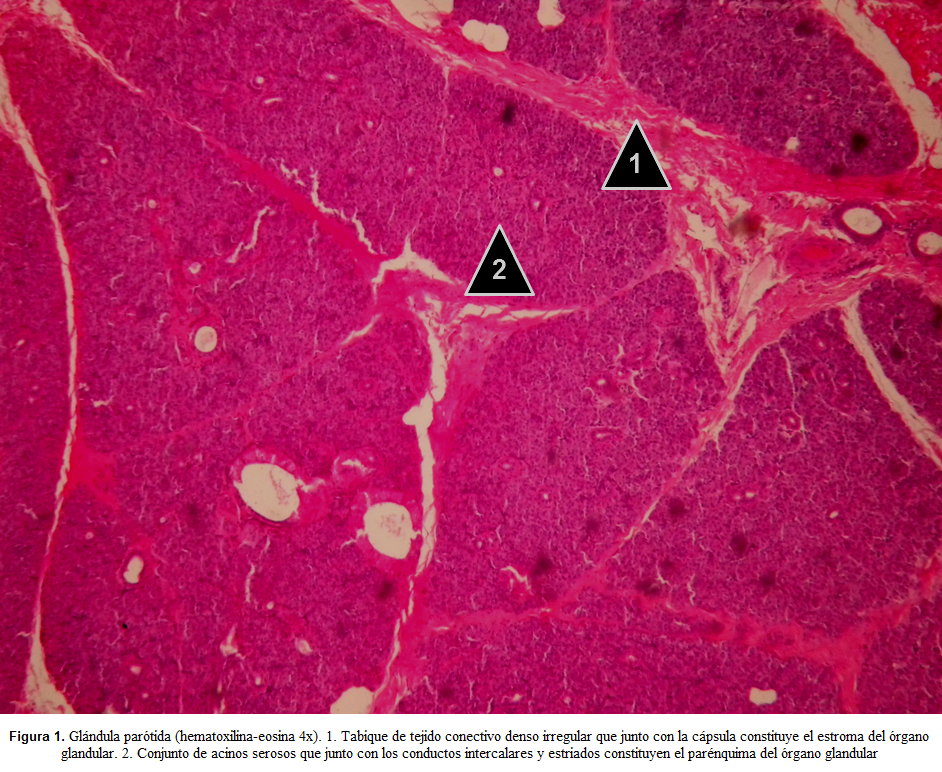
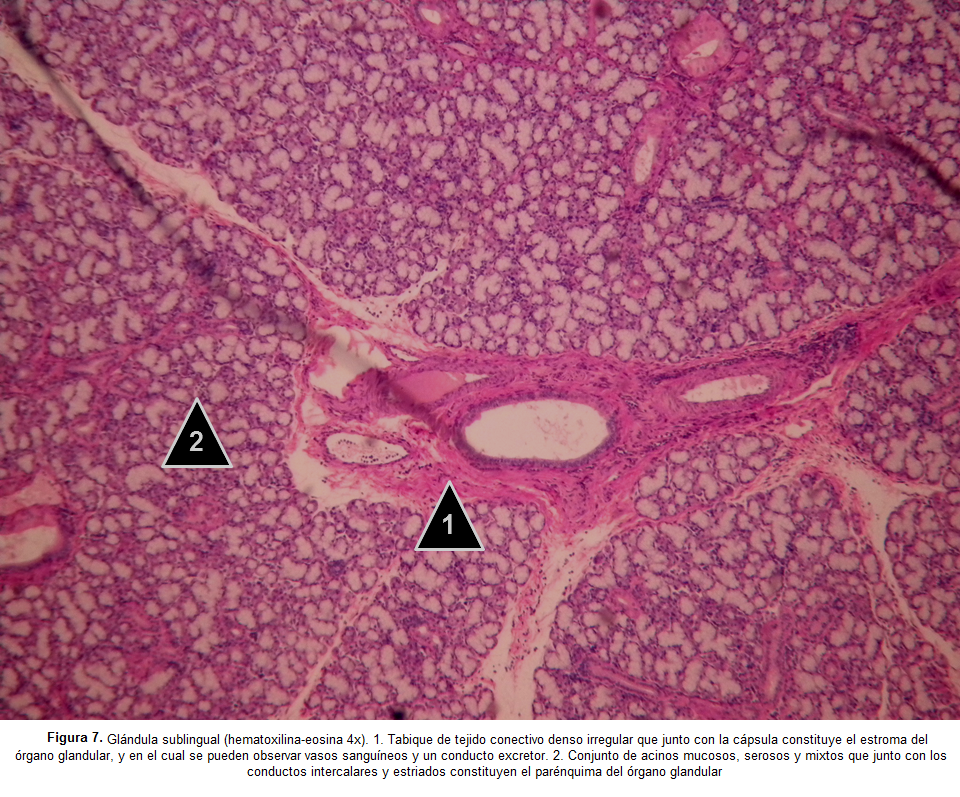
Tal como se ha manifestado, los tres pares de GSM se encuentran rodeadas por una cápsula de tejido conectivo denso irregular, el cual se invagina a manera de tabiques intralobulares en el parénquima para conformar lóbulos y tabiques intralobulillares para conformar lobulillos. La capsula y los tabiques constituyen el estroma mientras que lobulillos y lóbulos constituyen el parénquima funcional. De esta forma, la presentación de los resultados y la discusión de los mismos en esta revisión tema pretende establecer las diferencias, de acuerdo al abordaje y descripción histológica del estroma y del parénquima, de las GSM parótida, submaxilar y sublingual, paro lo cual se emplearán placas histológicas de muestras de glándulas humanas teñidas con hematoxilina-eosina a 4, 10 y 40 aumentos.
Parótida
De acuerdo a su morfología, la glándula parótida se clasifica como una glándula tubulo-acinar compuesta, cuyos acinos serosos se agrupan en lobulillos y lóbulos separados por tabiques de tejido conectivo denso irregular abundante en adipocitos que se proyectan desde una cápsula muy bien definida de tejido conectivo denso irregular. Los acinos serosos se encuentran constituidos por células triangulares que confluyen hacia una luz pequeña y central que se continúa con un conducto intercalar largo constituido por células cúbicas bajas que se organizan en un epitelio cúbico simple. Los conductos intercalares confluyen a los conductos estriados, los cuales se encuentran dentro de los lobulillos (intralobulillares) y se caracterizan por la presencia de células cúbicas altas con estriaciones basales (efecto histológico constituido por pliegues de la membrana celular del dominio basal y mitocondrias dispuestas en forma de columnas también en la región basal asociadas al transporte rápido de iones y agua) que se organizan en un epitelio cúbico simple. Los conductos estriados drenan hacia tubos colectores o excretores que se localizan en los tabiques y que, en la medida que van saliendo de la glándula, cambian su epitelio desde un cilíndrico simple a un plano estratificado mucoso que llega finalmente a la cavidad oral(19,38,39).
En placas teñidas con hematoxilina-eosina, las células serosas presentan un citoplasma intensamente acidófilo o eosinófilo (tonos rosa) por su naturaleza aniónica o ácida (basada en su polaridad negativa, la eosina es un compuesto ácido que le permite enlazarse con constituyentes celulares de carga positiva, de tal forma que tiñe organelas citoplasmáticas y el componente fibrilar de la matriz extracelular de los tejidos conectivos); y un núcleo redondo central basófilo o hematoxinófilo (tonos azul y púrpura), dada la naturaleza catiónica o básica (por su naturaleza positiva, la hematoxilina es un componen básico que tiñe fuertemente el núcleo debido a los ácidos nucleicos)(40,41) (Figuras 1-3).
Entre los acinos serosos (dominio basal de las células acinares) y el tejido conectivo laxo se encuentran las células mioepiteliales, representadas por núcleos planos alargados intensamente basófilos que circunscriben el acino; y también se encuentran agrupaciones de células no teñidas compatibles con adipocitos característicos asociados al tejido conectivo denso irregular (estroma) o al tejido conectivo laxo (parénquima), los cuales aumentan con la edad(19).
Los conductos intercalares, largos y con luces estrechas, son intralobulillares. Se encuentran constituidos por células cúbicas que se organizan en un epitelio cúbico simple cuyo citoplasma se observa eosinófilo y su núcleo central basófilo, razón por la cual resulta difícil identificarlos en medio de los acinos serosos de los lobulillos. Los conductos estriados, igualmente intralobulillares, se encuentran constituidos por células epiteliales cilíndricas que se asocian en un epitelio cilíndrico simple para constituir el conducto a partir de una luz amplia. Las células tienen igualmente eosinófilas, pero pueden diferenciarse por la presencia de una serie de estrías basales intensamente eosinófilas que corresponde a un efecto óptico de los repliegues profundos de la membrana plasmática y la presencia de abundantes mitocondrias organizadas paralelas a los repliegues en el dominio basal. Los conductos excretores, ubicados en el tejido conectivos de los tabiques intralobulares, se encuentran conformados por células cúbicas y cilíndricas, constituyen un epitelio pseudoestratificado. Estos conductos se observan igualmente eosinófilos(19,25,38) (Figuras 1-3).
Submaxilar
Igual que la glándula parótida, de acuerdo a su morfología se clasifica como una glándula tubulo-acinar compuesta, en cuyo parénquima se pueden observar acinos serosos, mucosos y mixtos (medialunas serosas asociadas a la periferia de acinos mucosos) por lo cual de acuerdo al tipo de secreción se clasifica como una glándula mixta con predominio seroso. Vale la pena resaltar que las medialunas serosas se constituyen en un artefacto histológico de la etapa de fijación durante la técnica histológica que resulta en la tumefacción de las células mucosas y expulsión hacia la periferia de las células serosas. Por tanto, in vivo, en el acino mixto realmente las células serosas se encuentran intercaladas entre las células mucosas y ambas vierten sus contenidos hacia la luz. Rodeando el parénquima se observa una cápsula de tejido conectivo denso irregular que se invagina a manera de tabiques entre los acinos y conductos formando lóbulos y lobulillos. El tejido conectivo laxo que rodea a los acinos se observa la presencia de linfocitos y células plasmáticas productoras de inmunoglobulina (IgA)(19,25,38).
En placas teñidas con hematoxilina-eosina se observan en las células serosas de los acinos serosos y mixtos (medialunas serosas) gránulos de zimógeno intensamente eosinófilos que se confunden con un citoplasma igualmente eosinófilo(25,38). Las células mucosas de los acinos mucosos y mixtos presentan un citoplasma pálidamente eosinófilo (apariencia de vacío de la célula mucosa asociado a la pérdida de los gránulos de mucinógeno durante la técnica histológica, los cuales no tiene afinidad específica por la eosina) (40,41), mientras que el núcleo, intensamente basófilo se observa aplanado y polarizado hacia el dominio basal(19) (Figura 4-6).
Los tres tipos de acinos se continúan con escasos conductos intercalares muy cortos que drenan a conductos estriados mucho más evidentes (debido a su longitud) que a su vez se continúan con conductos excretores que drenan a la cavidad oral. Los conductos intercalares y estriados se encuentran en la región del parénquima intralobulillar, en donde hay grandes concentraciones de acinos serosos, dado que los acinos mucosos tienden a conformar una morfología tubular en lugar de acinar; mientras que los conductos excretores, constituidas por un epitelio pseudoestaficado de células cúbicas y cilíndricas que circunscriben una luz bastante amplia, se observan directamente en los tabiques intralobulares de tejido conectivo denso irregular(19,25,38).
Sublingual
Conjunto de pequeñas glándulas tubulo-acinares compuestas cuyo sistema de conductos, constituido principalmente por conductos intercalados y estriados muy cortos, es independiente. Una cápsula delgada y menos definida de tejido conectivo rodea el parénquima constituido por acinos mucosos, acinos serosos (muy escasos) y acinos mixtos (acino mucoso con una medialuna serosa asociada), entre los cuales predominan los acinos mucosos, por lo cual la glándula sublingual se clasifica de acuerdo al tipo de secreción como una glándula mixta con predominio mucoso. Resulta plausible que realmente la medialuna serosa corresponda a células mucosas que durante la técnica histológica perdieron parcialmente los gránulos que contienen mucinógeno, dado que estas células no cumplen en sentido estricto con el concepto de apariencia vacía de las medialunas serosas de los acinos mixtos de las glándulas submandibulares; de la misma forma que el predominio de componentes de la saliva producida por las glándulas sublinguales son de origen mucoso(19,25,38) (Figura 7-9).
CONCLUSIONES
Dado que el objetivo de esta revisión de tema es hacer una descripción histológica de las tres glándulas salivales mayores a partir de placas con muestras humanas teñidas con hematoxilina-eosina, asociando las diversas estructuras histo-morfológicas a la fisiología, las conclusiones se presentan en el Cuadro 1, de tal forma que se pueda hacer una descripción diferencial de los componentes de las glándulas parótidas, submaxilares y sublinguales teniendo en cuenta aspectos biológicos moleculares dentro del contexto morfológico y funcional del sistema digestivo.
Cuadro 1
Características histológicas diferenciales de las glándulas salivares mayores en cortes teñidos con hematoxilina-eosina
Características |
Parótidas |
Submandibulares |
Sublinguales |
Clasificación morfo-histológica de la glándula: |
|
|
|
Mecanismo de secreción: |
|
|
|
Tipo de secreción: |
|
- Mixta (seromucosa) predominantemente serosa.
|
- Mixta (mucoserosa) predominantemente mucosa.
|
Estroma: |
- Cápsula de tejido conectivo denso irregular bien definida.
- Tabiques de tejido conectivo denso irregular bien definidos.
|
- Cápsula de tejido conectivo denso irregular bien definida.
- Tabiques de tejido conectivo denso irregular bien definidos.
|
- Cápsula de tejido conectivo denso irregular delgada y difusa.
- Tabiques de tejido conectivo denso irregular difusos.
|
Parénquima: |
- Lóbulos y lobulillos compactos bien definidos.
|
- Lóbulos y lobulillos a manera de “racimo de uvas” bien definidos.
|
- Lóbulos y lobulillos compactos bien definidos.
|
Acinos (porción secretora): |
|
- Serosos.
- Mucosos.
- Mixtos (mucosos con medialuna serosas).
|
- Serosos (muy escasos).
- Mucosos.
- Mixtos (mucosos con medialuna serosas).
|
Células epiteliales acinares: |
- Acinares serosas conformando acinos serosos (citoplasma eosinófilo intenso; núcleo basófilo, redondeado y polarizado hacia el dominio basal; luz muy pequeña).
|
- Acinares serosas conformando acinos serosos (citoplasma eosinófilo intenso; núcleo basófilo, redondeado y polarizado hacia el dominio basal; luz muy pequeña).
- Acinares mucosas conformando acinos mucosos (citoplasma eosinófilo / basófilo débil; núcleo basófilo aplanado y polarizado hacia el dominio basal; luz amplia).
- Acinares serosas conformando medialunas serosas en acinos mixtos con las mismas características que los acinos serosos. Acinares mucosas conformando acinos mixtos con las mismas características que los acinos mucosos.
|
- Acinares mucosas conformando acinos mucosos (citoplasma eosinófilo / basófilo débil; núcleo basófilo aplanado y polarizado hacia el dominio basal; luz amplia).
- Acinares serosas conformando medialunas serosas en acinos mixtos con las mismas características que los acinos serosos. Acinares mucosas conformando acinos mixtos con las mismas características que los acinos mucosos.
|
Conductos (porción excretora): |
- Conductos intercalares largos (abundantes en los cortes) y delgados (luces estrechas), ubicados en medio de los acinos (intralobulillares) y conformados por un epitelio cúbico simple.
- Conductos estriados bien desarrollados con luces amplias, ubicados en los lobulillos (intralobulillares) y conformados por un epitelio cúbico simple.
- Conductos excretores ubicados en los tabiques (extralobulillares) y conformados por un epitelio que va desde cúbico alto simple en su extremo distal, cilíndrico pseudoestratificado en su parte media proximal y plano estratificado mucoso en su extremo más proximal.
|
- Conductos intercalares cortos (escasos en los cortes respecto a parótida) y delgados (luces estrechas), conformados por un epitelio cúbico simple.
- Conductos estriados largos (abundantes en los cortes respecto a parótida), conformados por un epitelio cúbico simple.
- Conductos excretores ubicados en los tabiques (extralobulillares) y conformados por un epitelio que va desde cúbico alto simple en su extremo distal, cilíndrico pseudoestratificado en su parte media proximal y plano estratificado mucoso en su extremo más proximal.
|
- Conductos intercalares muy poco desarrollados, conformados por un epitelio cúbico simple.
- Conductos estriados cortos (escasos en los cortes respecto a submandibular), conformados por un epitelio cúbico simple.
- Conductos excretores ubicados en los tabiques (extralobulillares) y conformados por un epitelio que va desde cúbico alto simple en su extremo distal, cilíndrico pseudoestratificado en su parte media proximal y plano estratificado mucoso en su extremo más proximal.
|
Células epiteliales de los conductos: |
- Epiteliales cúbicas conformando un epitelio cúbico simple en los conductos intercalares (citoplasma eosinófilo, núcleo basófilo, redondeado y central).
- Epiteliales cúbicas altas conformando un epitelio cúbico simple en los conductos estriados (citoplasma eosinófilo, núcleo basófilo redondeado y central, y estriaciones intensamente eosinófilas en el dominio basal).
- Epiteliales cilíndricas altas y bajas conformando un epitelio psudoestratificado simple (citoplasma eosinófilo, núcleo basófilo, redondeado y en diferentes posiciones).
|
- Epiteliales cúbicas conformando un epitelio cúbico simple en los conductos intercalares (citoplasma eosinófilo, núcleo basófilo, redondeado y central).
- Epiteliales cúbicas altas conformando un epitelio cúbico simple en los conductos estriados (citoplasma eosinófilo, núcleo basófilo redondeado y central, y estriaciones intensamente eosinófilas en el dominio basal).
- Epiteliales cilíndricas altas y bajas conformando un epitelio psudoestratificado simple (citoplasma eosinófilo, núcleo basófilo, redondeado y en diferentes posiciones).
|
- Epiteliales cúbicas conformando un epitelio cúbico simple en los conductos intercalares (citoplasma eosinófilo, núcleo basófilo, redondeado y central).
- Epiteliales cúbicas altas conformando un epitelio cúbico simple en los conductos estriados (citoplasma eosinófilo, núcleo basófilo redondeado y central, y escasas estriaciones intensamente eosinófilas en el dominio basal).
- Epiteliales cilíndricas altas y bajas conformando un epitelio psudoestratificado simple (citoplasma eosinófilo, núcleo basófilo, redondeado y en diferentes posiciones).
|
Otras características: |
- Abundantes adipocitos que aumentan con el envejecimiento.
|
- Presencia de adipocitos (menor que en parótida) que aumentan con el envejecimiento.
|
|
REFERENCIAS
1. Khojasteh SMB, Delashou M. Microscopic anatomy of the parotid and submandibular salivary glands in European hamster (Cricetus cricetus L.). Internat Res J Applied Basic Scienc 2012; 3: 1544-1548
2. Hand AR, Pathmanathan D, Field RB. Morphological features of the minor salivary glands. Arch Oral Biol 1999; 44: 3-10
3. Garant PR. Oral cells and Tissues. Quintessence Books: Chicago 2003
4. Lingstrom P, Moynihan P. Nutrition, Saliva, and Oral Health. Nutrition 2003; 19: 567-569
5. Mandel ID. The functions of saliva. J Dent Res 1987; 66: 623-627
6. Valdez IH, Fox PC. Interactions of the salivary and gastrointestinal systems. I. The role of saliva in digestion. Dig Dis 1991; 9: 125-132
7. Pedersen AM, Bardow A, Jensen SB, Nauntofte B. Saliva and gastrointestinal functions of taste, mastication, swallowing and digestion. Oral Dis 2002; 8: 117-129
8. Dodds MW, Johnson DA, Yeh Ch-K. Health benefits of saliva: a review. J Dentistry 2005; 33: 223-233
9. Llena-Puy C. The role of saliva in maintaining oral health and as an aid to diagnosis. Med Oral Patol Oral Cir Bucal 2006; 11: 449-455
10. Gartner LP, Hiatt JL. Texto atlas de histología. Tercera edición. Mc Graw-Hill Interamericana: México 2008
11. Ten Cate AR. Histología Oral: Desarrollo, Estructura y Función. Segunda Edición. Editorial Médica Panamericana: Buenos Aires 1986
12. Moore KL, Persaud TVN. Embriología clínica: el desarrollo del ser humano. Séptima edición. Elsevier: Barcelona 2004
13. Sadler TW. Langman: embriología médica. Décimo segunda edición. Editorial Lippincott Williams and Wilkins: Barcelona 2012
14. Cutler LS, Gremski W. Epithelial-Mesenchymal Interactions in the Development of Salivary Glands. CROBM 1991; 2: 1-12
15. Tucker AS. Salivary gland development. Seminars in Cell & Developmental Biology 2007; 18: 237-244
16. Ianez RF, Buim ME, Coutinho-Camillo CM, Schultz R, Soares FA, Lourenc SV. Human salivary gland morphogenesis: myoepithelial cell maturation assessed by immunohistochemical markers. Histopathology 2010; 57: 410-417
17. Anselm M. Studies on the embryology and histology of the salivary glands and their endocrine nature. The American Biology Teacher 1968; 30: 666-673
18. Eynard AR, Valentych MA, Rovasio RA. Histología y embriología del ser humanos: bases celulares y moleculares. Cuarta edición. Editorial Médica Panamericana: Buenos Aires 2008
19. Ross MH, Pawlina W. Histología: texto y atlas color con biología celular y molecular. Quinta edición: Editorial Médica Panamericana 2010
20. Baum BJ. Principles of Saliva Secretion. Annals New Yorx Academy of Sciences. 1993; 693: 17-23
21. Turner RJ, Sugiya H. Understanding salivary fluid and protein secretion. Oral Dis 2002; 8: 3-11
22. Catalán MA, Nakamoto T, Melvin JE. The salivary gland fluid secretion mechanism. The Journal of Medical Investigation 2009; 56: 192-196
23. Melvin JE, Yule D, Shuttleworth T, Begenisich T. Regulation of fluid and electrolyte secretion in salivary gland acinar cells. Annu Rev Physiol 2005; 67: 445-469
24. Delporte C, Steinfeld S. Distribution and roles of aquaporins in salivary glands. Biochimica et Biophysica Acta 2006:1061-1070
25. Gómez de Ferrais ME, Campos A. Histología y embriología bucodental. Segunda edición. Editorial Médica Panamericana: México 2002
26. Pinkstaff CA. Serous, seromucous and special seros cells in salivary glands. Microsc Res Tech 1993; 26: 21-31
27. Chaudhry AP, Cutler LS, Yamane GM, Labay GR, Sunderraj M, Manak JR. Ultrastructure of normal human parotid gland with special emphasis on myoepithelial distribution. J Anat 1987; 152: 1-11
28. Tabak LA, Levine MJ, Mandel ID, Ellison SA. Role of salivary mucins in the protection of the oral cavity. J Oral Pathol 1982; 11: 1-17
29. Wu AM, Csako G, Herp A. Structure, biosynthesis, and function of salivary mucins. Mol Cell Biochem 1994; 137: 39-55
30. Piludu M, Rayment SA, Liu B, Offner GD, Oppenheim FG, Troxler RF, et al. Submandibular and sublingual glands electron microscopic immunogold localization of salivary mucins MG1 and MG2 in human. J Histochem Cytochem 2003; 51: 69-79
31. Redman RS. Myoepithelium of salivary glands. Microsc Res Tech 1994; 27: 25-45
32. Emmelin BN, Gjörstup P. On the function of myoephitelial cells in salivary glands. J Phymiol 1973; 230: 185-198
33. Kierszenbaum AL. Histología y biología celular. Segunda edición: Barcelona 2008
34. Dinudom A, Komwatana P, Young JA, Cook DI. Control of the amiloride-sensitive Na+ current in mouse salivary ducts by intracellular anions is mediated by a G protein. J Physiol 1995; 487: 549-555
35. Komwatana P, Dinudom A, Young JA, Cook DI. Control of the amiloride-sensitive Na+ current in salivary duct cells by extracellular sodium. J Membr Biol 1996; 150: 133-141
36. Cook DI, Dinudom A, Komwatana P, Young JA. Control of Na+ transport in salivary duct epithelial cells by cytosolic Cl- and Na+. Eur J Morphol 1998; 36: 67-73
37. Melvin JE. Chloride Channels and Salivary Gland Function. CROBM 1999; 10: 199-209
38. Leeson TS, Leeson CR, Paparo AA. Texto/atlas de histología. Interamericana McGraw-Hill: México 1998
39. Stevens A, Lowe J. Texto y atlas de histología. Mosby Doyma: Barcelona 1993
40. Greenwald SE, Brown AG. Histology and staining. In Biomedical Technology and Devices Handbook, Zouridakis G and Moore J (editors). CRC Press: London 2004
41. Bancroft JD, Gamble M. Theory and practice of histological techniques. Sixth edition. Churchill Livingston Elsevier: USA 2008